Základy chemické kinetiky
Chemické a biochemické reakce je vhodné popisovat pomocí diferenciálních rovnic. Elementární reakce podléhají kinetické rovnici, která popisuje rychlost, se kterou interagují dvě látky a vytvářejí třetí:
Koncentrace látek (v molech na jednotku objemu) se značí v hranatých závorkách a uvedenou reakci můžeme popsat rovnicí
kde derivace koncentrace je okamžitá změna koncentrace
tedy rychlost, s jakou je tvořen produkt reakce. Konstanta
je rychlostní konstanta, která vlastně konstantou není - závisí např. na teplotě nebo homogenitě směsi. Budeme ale předpokládat, že se teplota nemění a látky jsou dobře promíchané.
Příklad. Většina biochemických reakcí probíhá oběma směry:
V tomto příkladě popíšeme dynamiku této základní chemické reakce.
Změny koncentrací látek splňují
přičemž počáteční podmínky zde popisují situaci, kdy na počátku došlo k reakci látky
o koncentraci
s látkou
o koncentraci
a produkt
se teprve pak začal vytvářet. Chemický systém pak po čase dosahuje chemické rovnováhy, kdy se ustanoví koncentrace látek na jisté úrovni, která odpovídá rovnovážnému stavu diferenciálního systému s uvedenými počátečními podmínkami. Chemická rovnováha ve skutečnosti není neměnný stav, protože stále dochází k vzniku molekul látky
z molekul látek
a
a zároveň dochází také k rozpadu molekul
na
a
Pro produktpak platí následující rovnice (vysvětlete!):
s počáteční podmínkou
Označíme-li
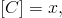
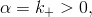
a
pak hledáme řešení počáteční úlohy
(1) Rovnovážné stavy jsou pak řešením rovnice
tj.
Diskriminant můžeme upravit jako
kde
se nazývá rovnovážná konstanta reakce. Úpravou pak vidíme, že
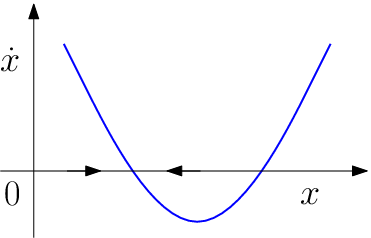
a rovnováhy jsou tedy vždy dvě, jejich hodnota závisí jak na počátečních koncentracích, tak na rychlostech reakcí. Situace je uvedená na následujícím obrázku.
Růst a klesání koncentrace
produktu
je vyobrazeno šipkami. Rovnováha se tedy ustanoví ve stabilním bodě blíž nule, druhý bod je nestabilní a nemá tedy chemický význam.
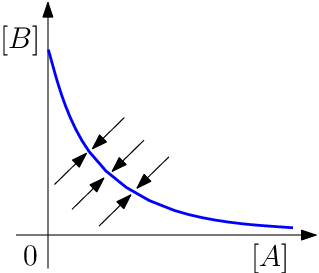
Pokud bychom sledovali naopak vstupy do chemické reakce, dostali bychom dvě rovnice
kde rovnováhy tedy budou splňovat
tj.
Fázový portrét systému ukazuje nasledující obrázek.
Běžné chemické reakce vytvářejí právě takovýto systém, jehož rovnováha je stabilní a nelze ji narušit náhodnými perturbacemi. Chemické reakce však nemusí mít jednu stabilní rovnováhu, mohou mít například dvě stabilní rovnováhy oddělené od sebe nestabilním stavem, tomuto jevu se říká bistabilita. Existence bistability umožňuje vznik tzv. biochemických přepínačů. Jinou možností narušení stability je existence limitních cyklů a vznik oscilací, tedy stabilního periodického řešení rovnice. První zmínka o oscilující chemické reakci je již z konce 17. století, kdy Robert Boyle pozoroval světelné záblesky při oxidaci fosforu. První oscilující reakci objevil r. 1921 W. Bray, když zkoumal katalytické působení jodičnanu na rozklad peroxidu vodíku v roztoku. Všiml si, že hnědé zbarvení roztoku vznikajícím jódem se periodicky objevuje a mizí, přičemž kyslík je periodicky produkován v pravidelných intervalech. Jeho objev mu však nezískal žádnou slávu, spíše naopak. Jím objevená reakce byla následujících 40 let ignorována, stejně jako dnes slavná Bělousovova reakce v 50. letech 20. století. Příčinou nedůvěry k publikovaným objevům byla chybná interpretace principů rovnovážné termodynamiky, která se stavěla k homogenním oscilačním reakcím jako k chemické obdobě perpeta mobile. Vznik oscilací byl spojován s heterogenními chemickými reakcemi nebo s biochemickými reakcemi, kdy se mechanizmu účastní ještě transportní děje. Změnu v názorech způsobil až v roce 1955 I. Prigogine, který ukázal, že oscilace mohou existovat v systémech, které jsou díky výměně hmoty nebo energie s okolím udržovány mimo termodynamickou rovnováhu.