Reálné biochemické děje
Reálné biochemické děje jsou samozřejmě daleko složitější a vstupuje do nich množství stavových proměnných a parametrů. Při jejich modelování se proto často pro některé stavové proměnné zjednodušeně předpokládá, že jsou v tzv. kvazistacionárním stavu, tedy splňují vůči jiné stavové proměnné nějakou nelineární rovnici. V modelu Michaelise-Mentenové to byl tvar přibližného řešení Biochemické modely (14), kde rychle se měnící proměnná vůči pomalu se měnící proměnné splňovala nelineární vztah
Obecněji se objevují i jiné racionální lomené funkce, které vyplývají dynamiky z FS-modelů jako kvasistacionární stavy pro jiné typy a soustavy reakcí. Nejčastější je tzv. Hillova funkce tvaru
pro
Genetické a biochemické přepínače založené na bistabilitě se běžně objevují v regulaci vnitřního prostředí u živých buněk a základní struktury, které jsme uvedli v předchozím textu jsou opravdu často zastoupeny ve vnitrobuněčných signalizačních sítích. Většina skutečných přepínačů a oscilátorů je velice komplexní vzhledem k potřebě mnoha regulačních vstupů, čímž vzrůstá robustnost systému. Pro samotnou existenci bistability nebo cyklu je nutná nelinearita, proto musí být i biochemické vlastnosti takového systému netriviální a vždy musí být v systému zahrnuta autokatalytická reakce (typicky enzymatická). Přesto i studium základních zjednodušených modelů vnitrobuněčných přepínačů je samo o sobě poučné a ukazuje základní principy biochemických mechanismů.
Příklad. Fosforylací aktivovaná kináza.
Kinázy (nejčastěji proteinkinázy) jsou enzymy, které se účastní širokého spektra buněčných pochodů, jako je regulace exprese genů, mitóza, buněčná diferenciace a proliferace nebo i programovaná buněčná smrt. V reálných dějích jde o několikastupňovou fosforylační kaskádu kináz, v níž v každém kroku předcházející kináza aktivuje tu následující. Zde uvedeme nejjednodušší strukturu, která umožňuje vznik genetické změny vlastní aktivitou. Jde o model samostatné fosforylací aktivované kinázy, která je transkripčním faktorem pozitivně regulujícím vlastní expresi v rámci genomu:kde
kvantifikuje aktivitu uvažované kinázy a


a
jsou kladné parametry. Parametr
odpovídá bazální (autonomní) produkci kinázy nezávisle na aktivitě
druhý člen
odpovídá genové expresi probíhající skrze transkripci a translaci v případě genetické změny fosforylací v biochemické signalizaci. Třetí člen
odpovídá rozkladu proteinu (transkripčního faktoru), defosforylaci. Substitucí
a reparametrizací času
dostáváme rovnici
(24) s bezrozměrnými parametry

Pokud bychom provedli analýzu průběhu funkce
zjistili bychom, že jde v kladných hodnotách o esovitou křivku s inflexním bodem
Jde navíc o funkci omezenou asymptotou
Rovnovážné body musí splňovat
je tedy zřejmé, že pro jisté hodnoty
bude mít systém Biochemické modely (24) tři rovnovážné body a vně tohoto intervalu jen jeden rovnovážný bod. Díky bistabilitě bude docházet k biochemickému přepínači na základě změny hodnot parametrů

a
ovlivňujících
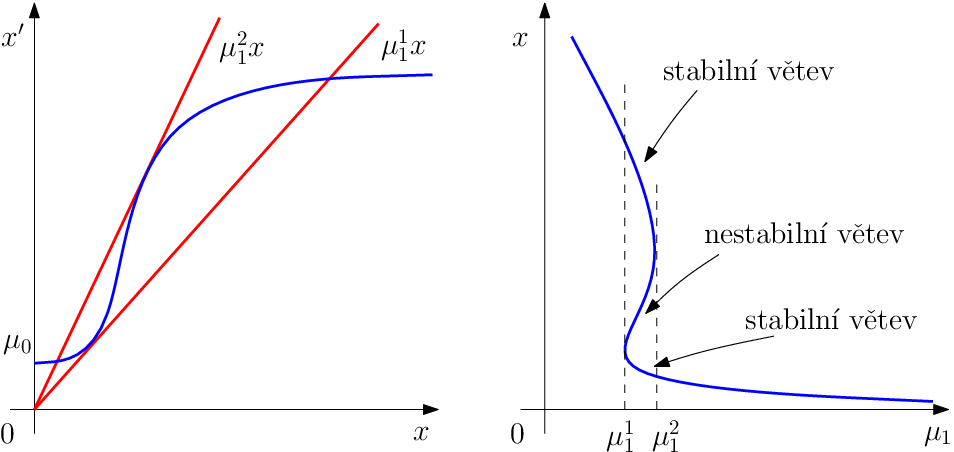
Následující obrázek ukazuje jednak grafické znázornění nalezení hodnot směrnic
a také rovnovážnou varietu závislou na parametru
reprezentujícím nějakou pomalou proměnnou.
Jak bylo řečeno, reálné biochemické děje jsou velmi složité. Pro představu zde uvedeme např. model trp operonu v genově-regulačním mechanismu bakterie Escherichia coli. Mnohé prokaryotické geny jsou tvořeny bloky, které se nazývají operony. Transkripci tohoto operonu řídí jisté transkripční faktory (většinou proteiny) v DNA, které regulují zahájení transkripce. Operony mají specifické funkce, např. Trp operon v E. coli má svou úlohu v syntéze aminokyseliny L-tryptofan, odtud je jeho název tryptofanový (trp) operon. Model (popis mechanismu necháme biochemikům) má tři diferenciální rovnice
|
|
|
(25) | |
|
|
|
||
|
|
|
kde je koncentrace části genu trpE trp operonu,
je koncentrace jistého inhibitoru (enzymu) a
je celková koncentrace L-tryptofanu. Vzhledem k dalším vztahům v genově-regulačním mechanismu trp operonu jsou koncentrace volného enzymu
a volného L-tryptofanu
vázány nelineárními funkcemi tvaru
navíc značí koncentraci v čase
jde tedy navíc o rovnici se zpožděním. Ostatní velké množství parametrů nebudeme uvádět, namátkou
je míra růstu bakterie,
rychlostní konstanta syntézy enzymu
atd. Tento model nebudeme studovat, slouží zde jen k získání představy, že i biochemické modely reálných dějů v buňkách jsou analogické, byť složitější. I v tomto modelu dochází k vzniku přepínače díky nelineárním funkcím na pravé straně systému.
Dalším důkladně studovaným příkladem reálného biochemického přepínače je lac operon, což je genetický přepínač využívaný střevními bakteriemi k rozhodnutí, který ze dvou cukrů, laktózu či glukózu, mají trávit. Přepínač je založen na proteinu LacI (laktózový inhibitor), který inhibuje transkripci lac operonu (lac operon kóduje proteiny potřebné k metabolizaci laktózy). Nicméně LacI je také inhibován produkty laktózového metabolismu, čímž vzniká spínač založený na vzájemné represi, tj. metabolity laktózy odstraní inhibitor a spustí se exprese genů pro zpracování laktózy. Stejně tak jako model trp operonu i tento model reálného děje by si zasloužil samostatnou kapitolu.
Příklad. Buněčný cyklus.
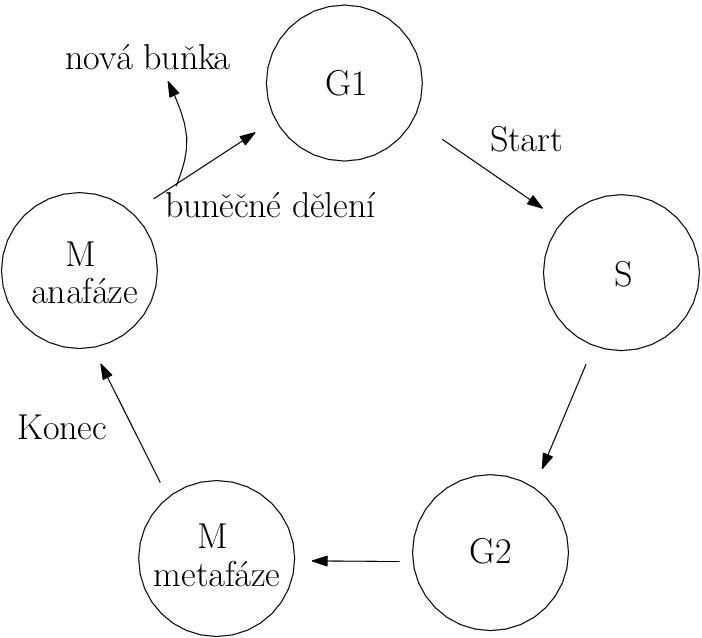
Jako příklad reálného děje, který alespoň částečně prostudujeme, zde uvedeme model buněčného cyklu. Půjde zase o přepínač, přestože v názvu modelu stojí cyklus. Buněčným cyklem budeme tedy rozumět posloupnost událostí, kterými buňka projde od svého vzniku po další dělení, tj. od dělení po dělení. Nejde tedy o mechanismus spojený s vznikem limitního cyklu jako periodické trajektorie systému (tyto modely si ukážeme v následující kapitole o neuronech), ale principem je spínač pro okamžik dělení buňky.U eukaryotických buněk má cyklus 4 fáze: G1, S, G2, M. S a M jsou fáze dělení. Ve fázi S dochází k duplikaci chromozomů (skládají se z DNA a histonů) a ve fázi M (mitóza) se sesterské chromatidy (dvě identické molekuly DNA) rozdělí tak, aby každá dceřiná buňka obsahovala kopii každého chromozomu. G1 a G2 jsou růstové fáze. Během fáze G1 buňka dorůstá do velikosti původní mateřské buňky; dochází ke zdvojení buněčné hmoty, tvoří se RNA a proteiny, připravuje se zásoba nukleotidů a enzymů pro replikaci DNA. Ve druhé růstové fázi (G2) se buňka připravuje na blížící se mitózu - dochází ke zdvojení a rozdělení některých organel a dalších buněčných struktur, tvoří se dělicí vřeténko.Buněčný cyklus budeme vnímat jako dva alternativní stavy buňky, G1 a S-G2-M oddělené dvěma přechody mezi nimi - Start a Konec, viz následující obrázek.
Toto rozdělení cyklu vychází z toho, že buňka po dokončení fáze G1 kontroluje, zda jsou vnitřní a vnější faktory příznivé pro přechod do další fáze. Pokud tomu tak není, může setrvat libovolně dlouho v klidové fázi. Přechod Konec odpovídá kontrolnímu uzlu před samotným dělením. Přechodem přes Start buňka potvrdí, že vnitřní i vnější faktory jsou příznivé pro další kolo syntézy a dělení DNA, a rozběhne se proces dělení buňky. Toto rozhodnutí buňky je nevratné, jakmile jednou začne syntéza DNA, není cesty zpátky, syntéza DNA musí být dokončena. Během procesu replikace DNA jsou sesterské chromatidy držené pohromadě proteiny jménem koheziny. Ve fázi M se vytvoří dělicí vřeténko a mikrotubuly z pólů vřeténka přitahují chromozomy a řadí je do řady uprostřed vřeténka (metafáze). V okamžiku, kdy je dokončena replikace DNA a všechny chromozomy jsou seřazené, nastává další nevratný přechod cyklu - Konec. Koheziny jsou zničeny, což umožní přemístění sesterských chromatidů na opačné póly vřeténka (anafáze). Krátce nato se kolem oddělených chromatidů utvoří buněčné jádro (telofáze) a vzniklé dceřiné buňky se oddělí.
Jedním z cílů současné molekulární biologie je vysvětlit fyziologii proliferace eukaryotické buňky. Je známo, že procesy uvnitř buňky jsou řízené systémem molekulárních signálů, jehož centrálními prvky jsou cyklin-dependentní kinázy (Cdk). Ve fázi G1 se v buňce vyskytuje pouze malé množství cyklinů aktivujících tvorbu Cdk, a tyto cykliny jsou rychle odbourávány. Aktivita Cdk je prakticky nulová. Na Startu je započata syntéza cyklinu a je zamezeno jeho odbourávání, což vede k výraznému nárůstu aktivity Cdk, přetrvávající ve fázích S, G2 a M. Vysoká hladina Cdk je potřebná pro replikaci DNA, kondenzaci chromozomů a tvorbu dělicího vřeténka. Na Konci je aktivován komplex proteinů APC, který určí, které proteiny mají být dále odbourány. APC se skládá z komplexu asi 12 polypeptidů a 2 pomocných bílkovin - Cdc20 a Cdh1. Tyto 2 proteiny je třeba důsledně rozlišovat, protože na proměnnou koncentraci cyklinu/Cdk reagují odlišně: její zvýšení vede k aktivaci Cdc20 a odbourávání Cdh1.
Významným procesem řídícím vývoj buňky je interakce mezi dvojicemi cyklin B/Cdk a Cdh1/APC. Biochemické reakce, které mezi nimi probíhají, lze zjednodušeně popsat pomocí soustavy diferenciálních rovnic
(26) Zde
a
představují koncentrace dimeru cyklin B/Cdk a komplexu aktivního Cdh1/APC. Hodnoty
jsou jsou rychlostní konstanty,
Michaelisovy konstanty,
je hmotnost buňky a
je parametr závisející na dalších interakcích. Členy v rovnici Biochemické modely (26) představují tvorbu a odbourávání CycB, přičemž rychlost odbourávání CycB je závislá na aktivitě Cdh1 (za předpokladu, že je hodně APC). Předpokládáme, že molekuly cyklinu B se rychle kombinují s nadbytečným Cdk, takže nemusíme sledovat monomery CycB a Cdk. Členy v rovnici Biochemické modely (27) reprezentují aktivaci a odbourávání Cdh1. Předpokládáme, že celková koncentrace Cdh1 je konstantní a normovaná (rovna jedné), tedy i komplex aktivního Cdh1/APC označený
musí splňovat
a dále také
Rovnovážné body leží na průsečících nulklin daných rovnicemi
což je v prvním kvadrantu klesající funkce (část hyperboly) a
kde
Tato funkce má průsečík s osou
v bodě
a má asymptotu
pro
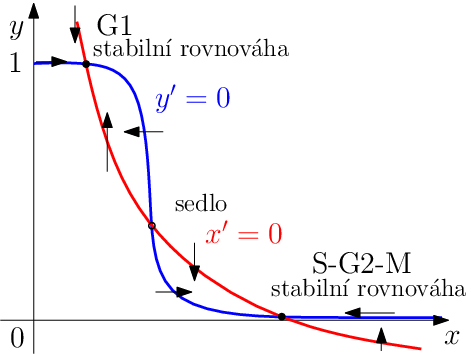
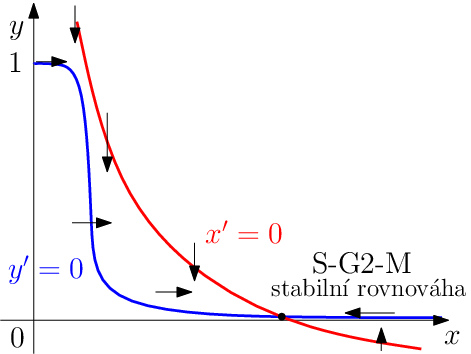
Pokud bychom provedli analýzu průběhu této funkce v prvním kvadrantu, zjistili bychom, že v závislosti na parametrech jde o více či méně esovitě prohnutou křivku. Nulkliny a fázový portrét tak můžeme vidět na schématickém obrázku Biochemické modely 11 a Biochemické modely 12.
Je vidět, ze dostáváme velmi citlivý přepínač. Pro malou, čerstvě vzniklou buňku ve fázi G1 je kontrolní systém CycB-Cdh1 přitahován ke stabilnímu stavu označenému G1. Když buňka roste, narůstá její hmotnost
a
klesá. Po jistém čase klesne hodnota
pod kritickou hodnotu, stav G1 zanikne zanikne a kontrolní systém bude přitahován k druhé stabilní rovnováze označené S-G2-M. Vysoká aktivita CycB/Cdk spustí procesy syntézy DNA a mitózy a buňka pokračuje v růstu. Když je dokončena replikace DNA a chromozomy jsou správně seřazeny v dělicím vřeténku,
se náhle zvětší (pro zdůvodnění změn hodnoty parametru
je třeba sledovat interakce mezi dalšími bílkovinnými strukturami) a dojde k nárůstu hodnoty
Buňka se rozdělí (hmotnost se zmenší na polovinu),
klesne k nule a systém CycB-Cdh1 se vrátí do počátečního stavu. Tento model je samozřejmě značně idealizovaný. Sledujeme totiž izolovaně vliv pouze několika málo řídících bílkovinných struktur, přestože je celá síť interakcí je složitější a silně propojená. Přesnější model lze najít například na stránkách http://mpf.biol.vt.edu/research/generic_ model/main/pp. Příčina sepnutí spínače pro dělení buňky je ale stejná, je to totiž nesnášenlivost jednotlivých bílkovinných struktur. V našem příkladě jde o nesnášenlivost mezi Cdk a APC: APC ničí aktivitu Cdk tím, že odstraňuje jeho partnerské cykliny, zatímco komplex cyklin B/Cdk tlumí aktivitu APC fosforylací Cdh1.