Analýza genomických a proteomických dat |
Současné výzvy a technologie genomiky a proteomiky |
Analýza sekvencí DNA |
Výstupy z výukové jednotky |
Úvod |
Moderní technologie analýzy genomu a proteomu a jejich datové výstupy |
Bioinformatika a statistika v analýze genomických a proteomických dat |
Princip a rozdělení DNA mikročipů |
Typy dat a potřeba jejich úpravy |
Základní kroky analýzy genomických a proteomických dat |
Standardy analýzy genomických a proteomických dat |
Software pro analýzu |
Příklady k procvičení |
Úvod |
Výstupy z výukové jednotky |
Základní kroky DNA mikročipového experimentu |
Výroba DNA mikročipového sklíčka |
Rozdělení mikročipů |
Příklady k procvičení |
Analýza obrazu (kvantifikace signálu) DNA mikročipů |
Výstupy z výukové jednotky |
Úvod |
cDNA mikročipy |
Oligonukleotidové mikročipy |
Příklady k procvičení |
Literatura |
Úprava a normalizace dat cDNA mikročipů |
Výstupy z výukové jednotky |
Úvod |
Kontrola kvality |
Normalizace cDNA mikročipů a vytvoření finální datové matice |
Úprava a normalizace dat oligonukleotidových mikročipů |
Normalizace v rámci mikročipu |
Příklady k procvičení |
Literatura |
Předpoklady normalizace uvnitř čipu |
Základní princip a metody normalizace uvnitř čipu |
Prostorová normalizace |
Normalizace na intenzitu pozadí |
Normalizace odchylek barviva |
Normalizace mezi mikročipy |
Sumarizace a vytvoření finálního datového souboru |
Výstupy z výukové jednotky |
Úvod |
AffyBatch - R datová struktura pro oligonukleotidové mikročipy |
Kontrola kvality |
Normalizace a sumarizace |
Příklady k procvičení |
Literatura |
Základní schémata statistické analýzy dat |
Výstupy z výukové jednotky |
Porovnávání skupin |
Analýza arrayCGH |
Analýza genových sad |
Výpočet velikosti účinku |
Testování hypotéz u genomických a proteomických dat |
Praktický příklad analýzy |
Objevování skupin |
Predikce skupin |
Analýza přežití |
Příklady k procvičení |
Databáze genových sad/pathways |
Nástroje pro analýzu genových sad |
Studijní materiály a software |
Analýza dat hmotnostní spektrometrie |
2D gelová elektroforéza |
Veřejně dostupné databáze dat |

cDNA mikročipy
Každé fluorescenční barvivo je excitováno podle odlišných UV vlnových délek, tato vlastnost umožňuje porovnávat dva vzorky na stejném mikročipovém sklíčku. Toho se využívá u dvoukanálových cDNA mikročipů (viz obrázek 3.1). Zde je DNA jednoho vzorku označena jedním fluorescenčním barvivem (např. Cy3, zelená barva), DNA druhého vzorku je označena jiným fluorescenčním barvivem (např. Cy5, červená barva). Oba vzorky jsou pak hybridizovány na mikročipovém sklíčku, kde se kompetitivně vážou na sondách s komplementárními sekvencemi. Skener zachytí obrázek pro každý kanál (fluorescenční barvivo) individuálně a dva obrázky jsou později v procesu analýzy obrazu sloučeny dohromady.
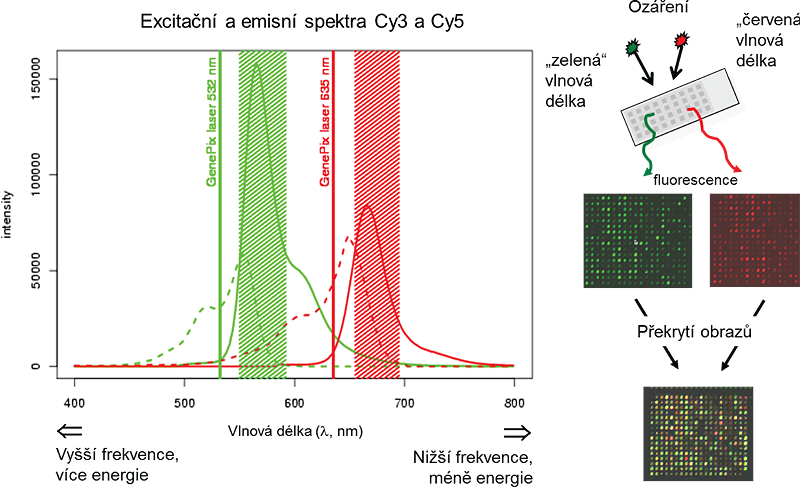
Obr.3.1: Princip dvoukanálové fluorescence využíván u cDNA mikročipů.




