Time-of-flight spektrometrie
TOF spektrometr separuje ionty na základě času, kterým putují k detektoru. Obecně, ionty s větší hmotností putují pomaleji než ionty s nižší hmotností. Také, ionty s vyšším nábojem putují rychleji než ionty s nábojem nižším, jak ilustruje obrázek níže. V tomto případě je ionizační zdroj laser a matice na které jsou proteiny:
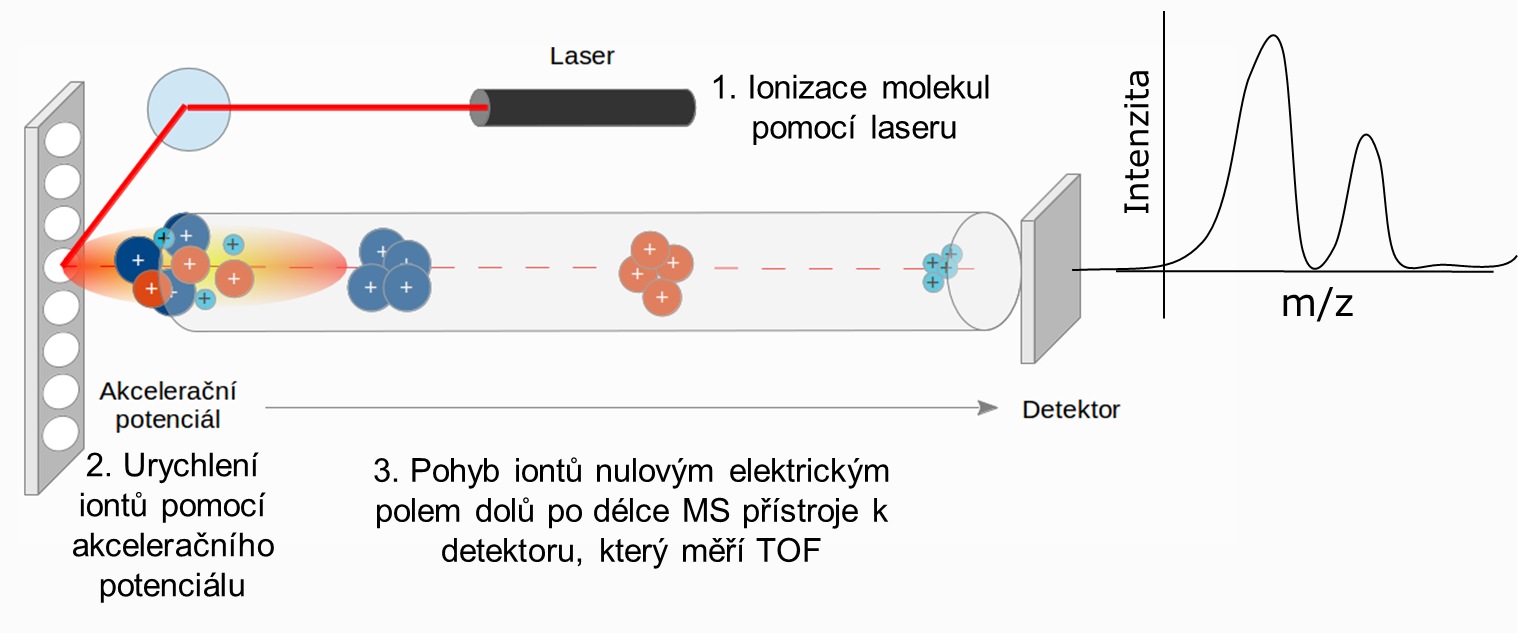
TOF (time-of-flight) závisí na hmotnosti proteinů nebo přesněji na jejich m/z (hmotnost k náboji) a představuje sumu těchto časů:
TOF = ta + tD + td, kde
ta je čas letu v akcelerační oblasti,
tD je čas přeletu v oblasti s nulovým elektrickým polem
td je čas detekce
TOF lze aproximovat pouze pomocí tD , mass-to-charge ratio je pak vypočteno podle:
m/z = B( tD - A)^2
A a B jsou stanoveny pomocí kalibrace.
Nejpoužívanější jsou dvě technologie:
- Matrix-Assisted Laser Desorption-Ionisation (MALDI)-TOF
- Surface-Enhanced Laser Desorption-Ionisation (SELDI)-TOF
Proteiny vzorku jsou před samotnou analýzou upevněny na podklad, který se v závislosti od typu hmotnostní spektrometrie liší. Jeho úkolem je také absorbovat energii v ionizátoru a předat ji vzorku a tak usnadnit jeho ionizaci.
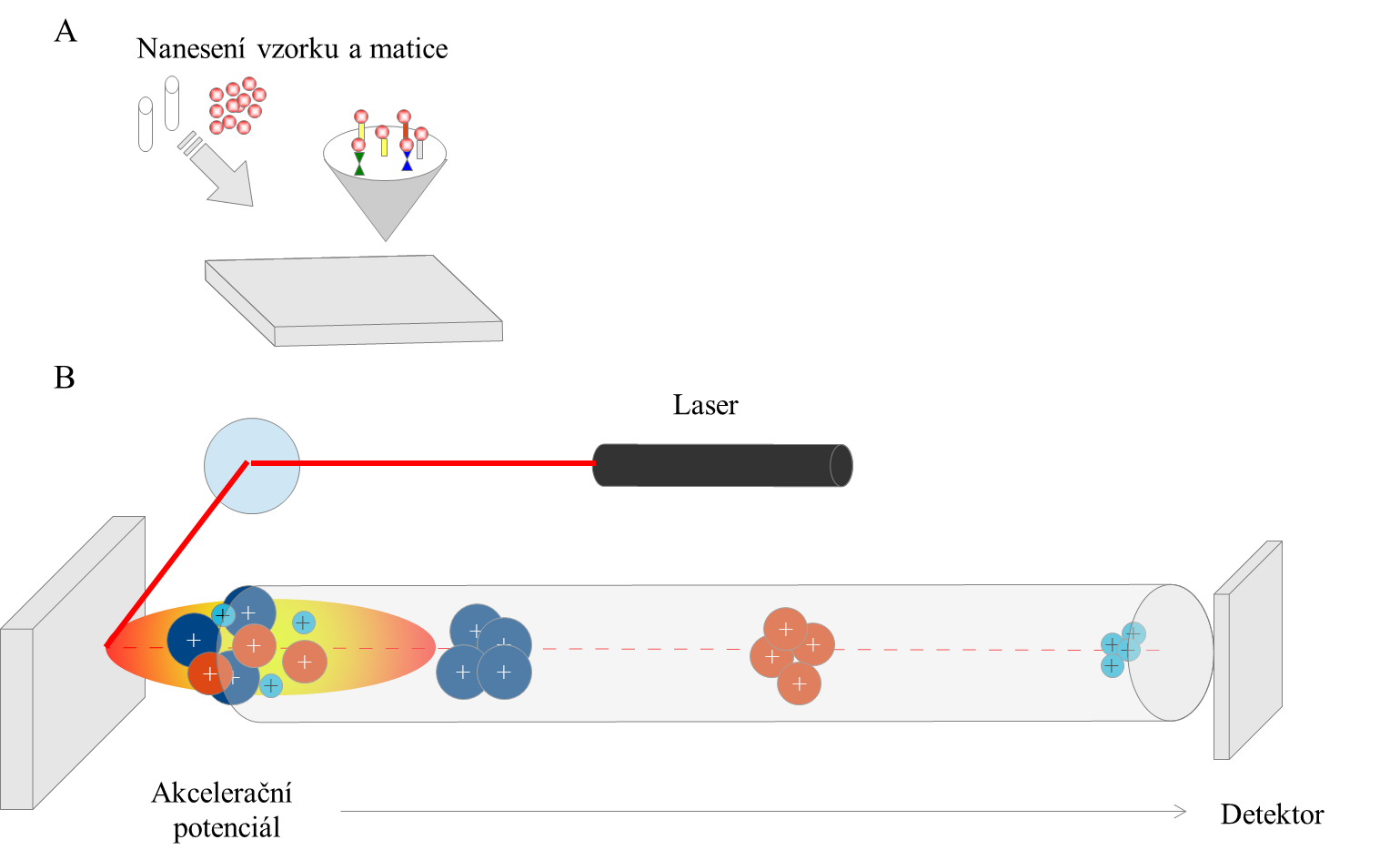
Matrix-Assisted Laser Desorption-Ionisation (MALDI)-TOF
U MALDI see jedná o energii-absorbující matrici (matrix), což je nejčastěji organická kyselina s aromatickým jádrem:
Surface-Enhanced Laser Desorption-Ionisation (SELDI) – TOF
SELDI využívá proteinový čip (s několika - obvykle osmi - spoty), opatřen speciálním chromatografickým povrchem, takže se na povrch váží různé proteiny v závislosti na svých chemických vlastnostech a vlastnostech čipu. A až potom dojde k nanesení matrice, která se vzorkem vytvoří krystaly.
Existuje několik druhů čipů (IMAC30, H50, NP20...), které se liší svým aktivním povrchem (anionický, kationický, kovový, normální fáze, hydrofobický, …) a proto také přednostně vážou jiné molekuly.
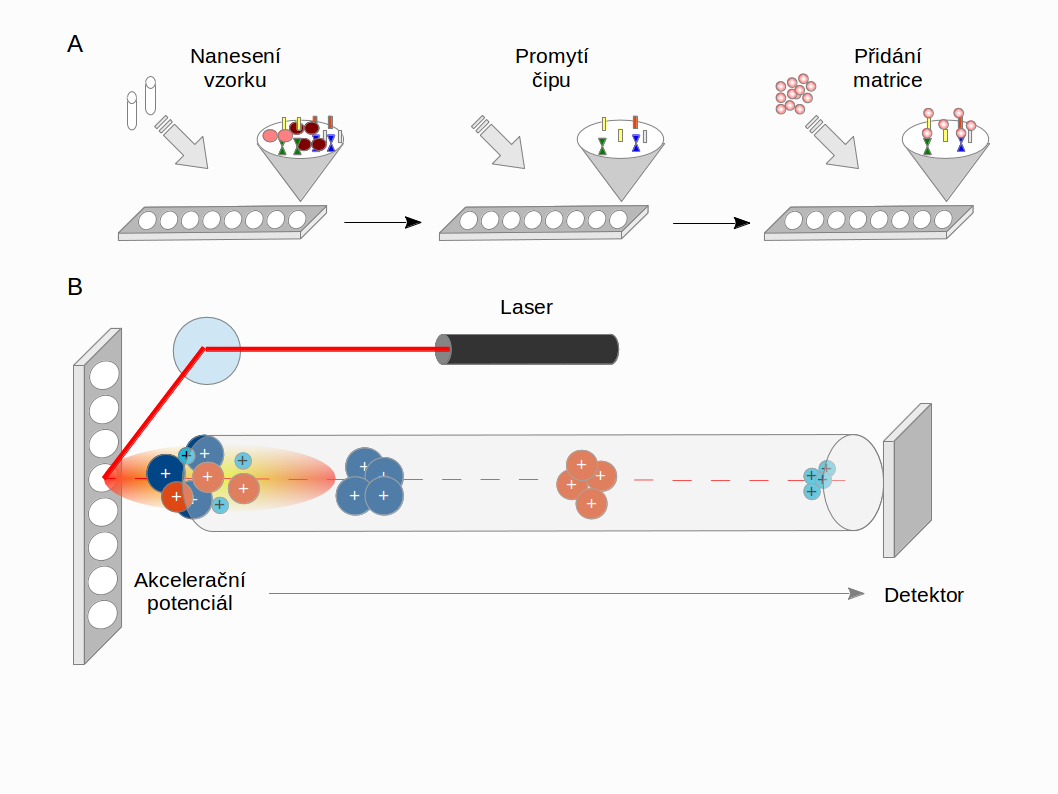
Výhodou SELDI je, že máme možnost odmýt látky, které by jinak ovlivňovali spektrum vzorku (např. močovina používaná k přípravě vzorku, nebo Na+ ionty přítomné fyziologicky ve vzorcích).
Čipy pro SELDI-TOF:
Kvantitativní hodnoty proteomu jsou také ovlivněné různými zdroji variability (experimentální i biologické).
Velmi velké rozdíly jsou mezi různými typy použitého čipu, viz tabulka níže, která zobrazuje procenta společně detekovaných píků stejného vzorku analyzovaného pomocí SELDI a čtyř různých čipů. Tabulka není symetrická, je nutno ji číst po sloupcích, např: Ze všech píků nalezených na čipu IMAC30 se jich našlo 19 (47.5%) také na čipu H50:
| H50 | IMAC30 | NP20acid | NP20alkaline | |||||
| N | % | N | % | N | % | N | % | |
| H50 | 75 | 100 | 19 | 47,5 | 24 | 52,2 | 56 | 59,6 |
| IMAC30 | 19 | 25,3 | 40 | 100 | 19 | 41,3 | 21 | 22,3 |
| NP20acid | 24 | 32 | 19 | 47,5 | 46 | 100 | 30 | 31,9 |
| NP20alkaline | 56 | 74,7 | 21 | 52,5 | 30 | 65,2 | 94 | 100 |
| % odlišných m/z | 15 | 20 | 15 | 37,5 | 12 | 30 | 28 | 29,8 |
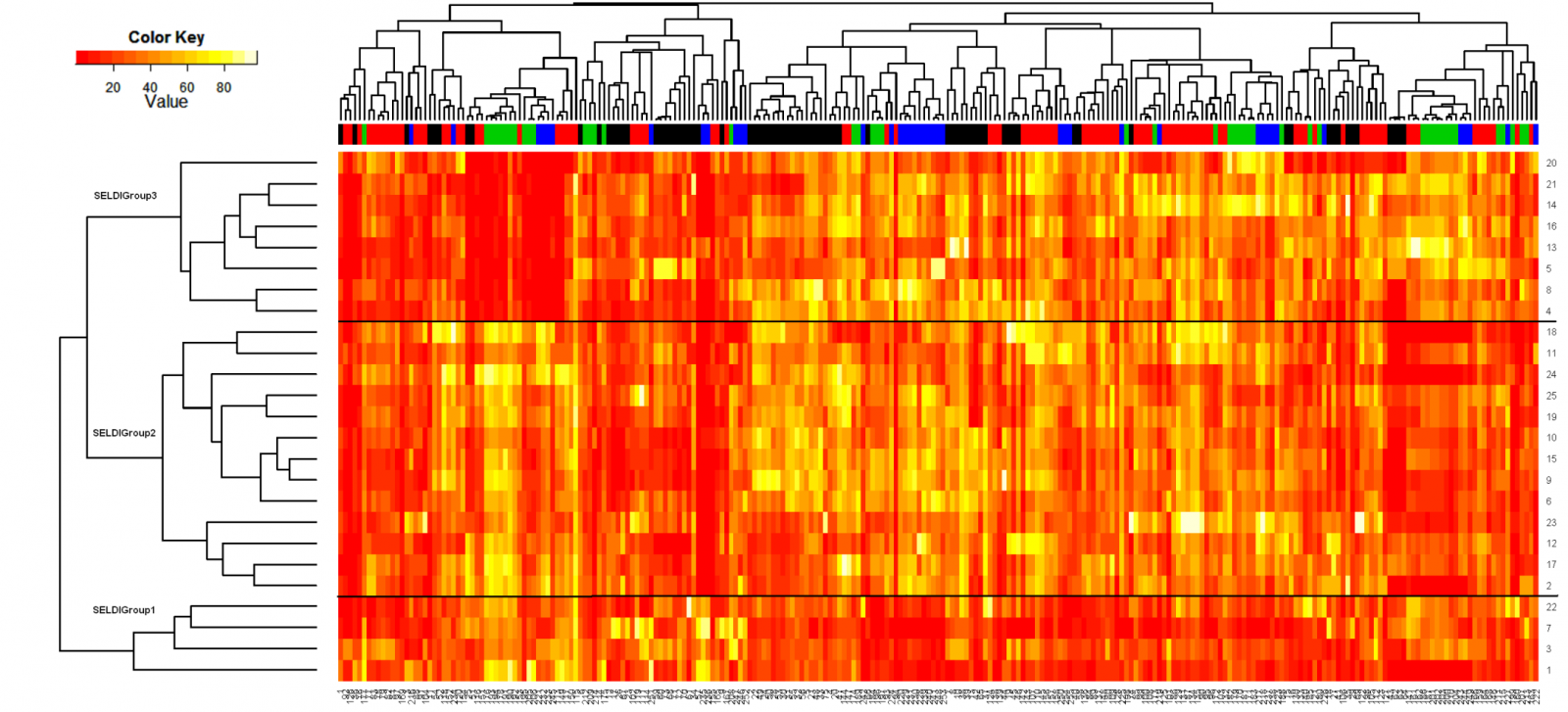
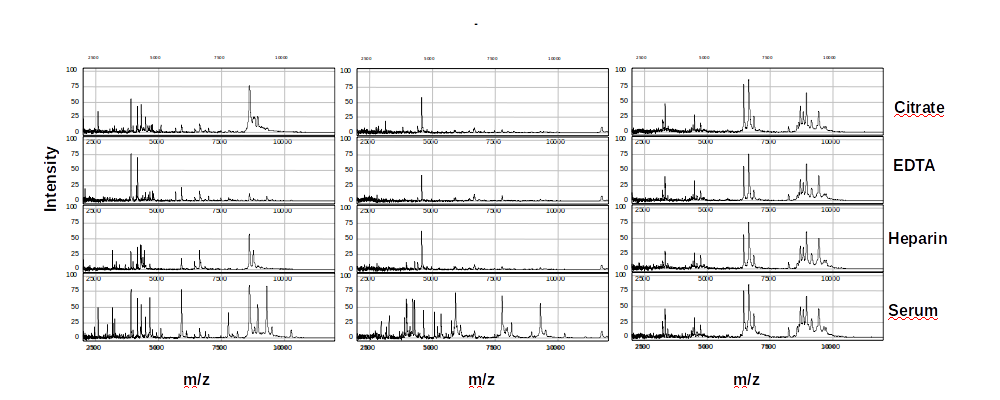
Jak může způsob spracování vzorku ovlivnit výsledek analýzy demonstruje obrázek níže, který ukazuje píky profilů tří odlišných SELDI čipů. Jde o vzorky zpracované 4 různými způsoby. (Banks et al, Clinical Chemistry 2005)
Tato heatmapa ukazuje, že hierarchické shlukování profilů vzorků z tabulky výše, ze 4 typů SELDI sklíček, by mělo vzorky shluknout spíše podle vzorky než podle typu čipu:
legenda: IMAC30, H50, NP20zas, NP20kys